熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
摘要:
在肝門螺桿菌中檢測到了氫氧化氫酶活性,并將其與幽門螺桿菌中氫攝取呼吸氫化酶相關的特征進行了比較。完整的全細胞可將氫氣氧化與氧氣攝取耦合,在沒有氧氣的呼吸途徑下,觀察不到氫氣攝取。肝螺桿菌酶可以將氫氣氧化與許多正電位受體的還原耦合,并進行無氧或還原活化。肝螺桿菌對氫氣分子有很強的親和力(表觀Km為2.5μM),對活體小鼠肝臟進行的微電極測量表明,宿主組織中的氫氣水平是全細胞表觀Km值的20倍。
引言:
大多數螺旋桿菌成員都不是胃黏膜的定植者,但胃定植者(幽門螺旋桿菌)受到了大部分研究的關注。然而,作為動物的重要天然定植者和新出現的病原體,腸肝型螺旋桿菌也開始受到研究。它們在人類和其他哺乳動物的腸道(有時也在肝臟)中定植,其中許多被認為是正常腸道菌群的一部分。肝螺旋菌是這一多樣化螺旋菌群中的一員;它最初是從肝炎和肝腫瘤發病率較高的小鼠菌株中分離出來的。從那時起,這種細菌與肝臟疾病(慢性活動性肝炎、斑疹傷寒和肝細胞瘤)和腸易激綜合征類似癥狀的相關性變得越來越強,但肝螺旋桿菌尚未從人類肝臟中分離出來。然而,肝螺旋體與其他動物(包括靈長類動物)的病變肝組織有關,這一事實引發了人們對肝螺旋體生理學的更多關注。同樣,有報告稱肝螺旋菌DNA的存在與(人類)原發性肝病患者有關。DNA與(人類)原發性肝癌患者相關的報道進一步激發了人們對肝螺旋菌的興趣。
最近,我們研究小組的成員發現,H2攝取型氫酶活性是細菌的一種特性,對于賦予幽門螺桿菌定植能力非常重要。氫氧化是自然界中常見的幾種可能的還原底物之一,因此許多不同的呼吸道細菌都會進行氫氧化。低低勢電子可以與能量守恒過程相結合,這種能力很可能有助于幽門螺桿菌在胃黏膜能量貧乏的環境中存活。幽門螺桿菌對高能量可擴散底物(H2)的親和力,結合微電極測量來評估活體小鼠胃中的H2水平,使我們得出結論,當幽門螺桿菌在宿主體內生長時,H2已達到飽和狀態。據測定,H2是人類和嚙齒類動物腸道排泄的產物(由于腸道菌群的產生),而且據推測,H2會通過動物的血管系統攜帶。我們的目標是確定H2的可用性及其作為呼吸底物的潛在代謝,以便肝吸蟲進行可能的能量守恒。與相關的胃氫測量工作一樣,我們在活體小鼠肝臟中檢測到了充足的分子氫水平,這一水平遠遠超過了肝吸蟲對H2的親和力(表觀Km值)。在此,我們對肝吸蟲體內的一種氫氧化氫酶進行了部分鑒定,并就與吸收型氫酶相關的一些主要特征與幽門螺桿菌氫氧化系統進行了比較。
材料與方法:
在我們開始本研究之后,有報道稱對肝吸蟲進行了部分基因組序列分析;確定了56個編碼區,其中一個編碼區是琥珀酸梭菌hydB的部分直向同源區(85%的同一性)。這表明該細菌含有鎳鐵氫酶的大亞基。氫化酶既能產生氫氣,也能消耗氫氣,它們在酶學和生理學上發揮著不同的作用。為了幫助確定肝吸蟲體內是否存在假定的H2攝取氫酶,我們進行了直接安培氫酶測定。肝菌ATCC 51449在厭氧罐中的血瓊脂平板上生長,氣氛為5%CO2、10%H2和剩余的N2。細菌在37°C培養5天后,將棉簽上的細胞重懸于磷酸鹽緩沖鹽水(PBS)中,然后離心。重新懸浮細胞團,然后重復離心步驟。懸浮細胞在PBS中的濃度約為每毫升2109個細胞。這相當于600納米波長下的光密度約為1.0,最初需要使用超過25個血瓊脂平板來進行6至10次獨立的氫化酶檢測。比較肝吸蟲和幽門螺桿菌除了生長2天即可收獲細胞外,后一種細菌的培養和處理方法相同。
結果:
肝吸蟲全細胞能夠將H2氧化與呼吸消耗O2結合起來。在無氧狀態下沒有觀察到H2吸收。不過,我們立即注意到,H2氧化的速率低于我們通常觀察到的幽門螺桿菌。為了精確地解決這一問題,我們將肝吸蟲的H2氧化活性與在相同條件下(在含10%H2的環境中培養的血瓊脂平板)生長的兩種常見幽門螺桿菌菌株的H2氧化活性進行了比較。
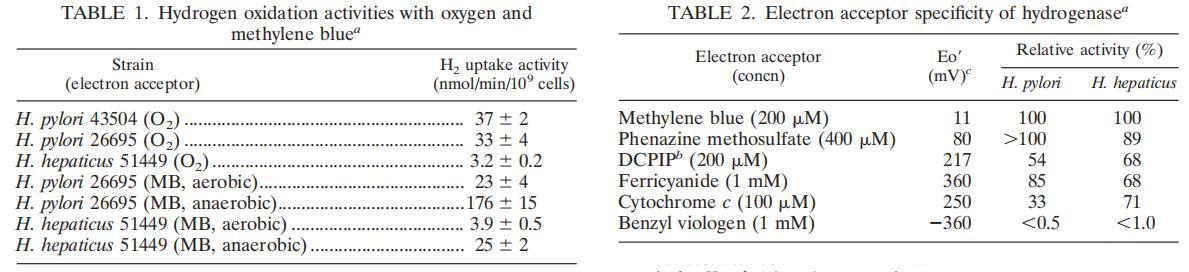
表1,微電極測定小鼠肝臟中的氫濃度。a:測量的部位包括肝臟所有的葉片;測量方法是將50μM長的氫氣傳感探針插入活體(但已麻醉)小鼠體內;小鼠為雌性C57BL品系,使用氟烷麻醉。
表1顯示,肝吸蟲的H2-O2呼吸途徑只有幽門螺桿菌的10%左右(按每個細胞計算)。整個細胞的H2氧化依賴于氧氣的加入,因為在厭氧條件下沒有觀察到H2吸收(或進化)。
據報道,吸收型氫化酶會出現厭氧活化(有時稱為還原活化)現象。其特點是在高度還原或無氧條件下,酶的活性要高得多。當反應混合物中存在氧氣時,肝菌酶的厭氧氫氧化率僅為16%(表1)。這一厭氧活化量與我們觀察到的幽門螺桿菌細胞(表1)以及我們之前從臨床幽門螺桿菌分離物中觀察到的膜相似。對于已經詳細研究過這種厭氧活化的系統來說,在還原條件下實現全部活性與電子受體還原速率(即氫酶周轉率)有關。
眾所周知,氫氧化氫酶對底物具有高親和力。為確定肝吸蟲酶對該細菌體內生長的有用性,測定了氫的全細胞邁克爾常數(表觀Km)。分子氫的全細胞Km是按照之前的描述,使用限制氫濃度下全細胞氫酶活性的Lineweaver-Burk圖確定的。這一表觀Km值為2.5 M(三次實驗的平均值),表明其對氫的親和力很高。這一表觀Km是在活的完整細胞中測定的,其中氧氣是氫氧化呼吸鏈中唯一的終端電子受體。因此,我們所報告的表觀Km是針對整個功能正常的氫氧化系統的。
肝吸蟲氫化酶的特征與幽門螺桿菌報告的特征相似,因此肝吸蟲系統很可能也是膜結合的,并參與能量守恒。在"H2分裂"步驟之后,它很可能涉及其他與膜相關的電子傳遞蛋白的還原。因此,我們確定了該H2氧化系統在染料介導的氧化還原電位范圍。通常情況下,H2攝取氫化酶是在正氧化還原電位受體的作用下發揮作用的,而不是在負氧化還原電位受體的作用下。
就幽門螺桿菌而言,肝吸蟲酶能夠將H2氧化與正氧化還原受體(表2)結合起來,但不能與負氧化還原受體芐基紫精結合起來。這些實驗都是在無氧條件下進行的。幽門螺桿菌和肝吸蟲系統之間的一個有趣區別是細胞色素c是否適合作為氫酶的受體。中等氧化還原電位的細胞色素c是肝吸蟲氫化酶的良好受體;這可能意味著肝吸蟲體內氫化酶的電子受體比幽門螺桿菌膜中的初始受體處于更高的氧化還原電位(醌或細胞色素)。我們之前已經證明,幽門螺桿菌中的氫氧化與細胞色素還原有關,這些含血紅素的成分在末端(與O2結合)氧化酶還原之前充當中間電子載體。然而,肝吸蟲無法進行這些差異光譜實驗,因為無法獲得氫氧化膜顆粒。膜分離是在限制氧氣的條件下進行的(在細胞破壞過程中和之后使用氬氣充氣的緩沖液,并通過氬氣充氣的注射器轉移提取物),但并不是在嚴格的厭氧條件下進行的,因此有可能存在O2易變因子在H2-O2呼吸鏈中存在。然而,由于H2氧化與O2吸收相耦合,并且與正電位染料的還原相耦合,因此肝吸蟲膜中可能存在(尚未確定的)含血紅素的成分,這些成分參與保存最初由H2提供的電子的能量。
我們使用改良的克拉克型微電極H2-50(Unisense A/S,丹麥奧胡斯),以安培法測定活體成年小鼠肝臟中的氫濃度(表3)。用氟烷麻醉雌性C57BL小鼠。在整個過程中,小鼠保持活著但完全麻醉,并在最后一次測量后立即安樂死。手術暴露肝臟,將微電極插入肝臟組織;大多數測量是在探針進入肝臟不到1.0毫米時進行的,以免損壞(脆弱的)探針。事實上,在最初的一些測量中,當試圖將探針插入組織更深處時,探針確實受到了損壞。氫氣讀數是在信號穩定后(約5到7秒)記錄的。每只小鼠肝臟最多可在12個部位重復這一過程。按照制造商的描述,使用其校準室獲得氫氣的標準曲線。平均氫氣水平超過50 M,因此超過表觀Km 20倍,并略微超過我們報告的小鼠胃部H2水平。組織氫氣測量結果共同支持了一個假設,即動物體內的許多組織中都存在氫氣,因此有必要進一步考慮氫氣作為能量庫供宿主動物體內的感染性細菌使用的可能性。
 相關新聞
相關新聞